M6 zur Prävention von durch Chemotherapie verursachten peripheren Neuropathien: eine Studie
04 April 2022 - Forschung
NEUROLASER ist der Name der jüngsten Pilotstudie, die von einem Forscherteam der medizinischen Fakultät der Hasselt University in Zusammenarbeit mit Ärzten der Abteilungen für Onkologie und Neurologie des Jessa Hospitals (Hasselt, Belgien) durchgeführt wurde.
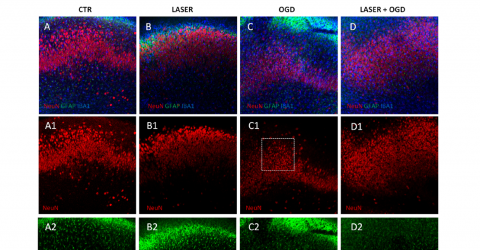
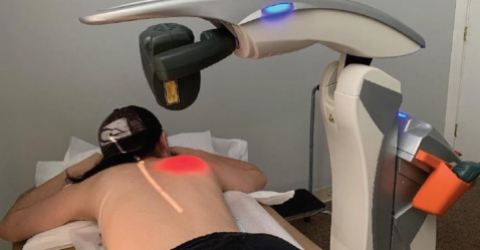
Die klinische Studie untersuchte die Wirksamkeit und Sicherheit der Photobiomodulationstherapie (PBMT) mit einer Laserquelle (M6) zur Prävention der durch Chemotherapie induzierten peripheren Neuropathie (CIPN) bei Brustkrebspatientinnen.
Das von Dr. Robijns geleitete Team nahm 32 Patienten in die Studie auf, von denen 16 einer PBMT und 16 einer Placebo-Behandlung unterzogen wurden.
Die erhobenen Daten zeigten vielversprechende Ergebnisse in Bezug auf die Prävention. Symptome wie Taubheitsgefühle in Händen und Füßen verschlechterten sich in der Kontrollgruppe erheblich, während sie in der mit PBM behandelten Gruppe konstant blieben. Auch die Lebensqualität der behandelten Patienten verbesserte sich im Vergleich zu den Patienten der Kontrollgruppe. Alle Lasertherapiebehandlungen erwiesen sich als sicher und frei von unerwünschten Wirkungen.
Weitere Studien sind erforderlich, um die Anwendbarkeit und Wirksamkeit der Lasertherapie bei der Prävention von durch Chemotherapie ausgelösten peripheren Neuropathien eindeutig zu bestätigen. Diese vorläufige Studie liefert jedoch ermutigende Ergebnisse zur Möglichkeit der Anwendung des M6-Systems zur Unterstützung von Therapien für Krebspatienten, wie dies bereits durch frühere Erfahrungen im Zusammenhang mit der Behandlung von Radiodermatitis deutlich wurde.
Testo a Destra
Immagine 30%/Testo 60%

“The use of photobiomodulation therapy for the prevention of chemotherapy-induced peripheral neuropathy: a randomized, placebo-controlled pilot trial (NEUROLASER trial)”
Supportive Care Cancer, Mar 21;1-9, 2022